过氧化氢纳米酶研究新突破
水铁矿纳米酶:与以往氧化铁纳米酶的多酶活性不同,它具有相对专一的过氧化氢酶活性,能够催化H2O2分解产生O2,其活性位点是铁与铁合羟基形成的催化中心而非单一的铁元素。水铁矿是细胞内参与铁代谢的物质,因此这种纳米酶安全性高,可用于肿瘤的放疗增敏。
纳米酶(Nanozyme)是一类蕴含酶学特性的纳米材料,具有催化活性高、稳定、低成本和易于大规模生产等特点。自2007年首次报道Fe3O4纳米酶以来,许多种类纳米酶被开发出来,并在生化检测、环境管理、疾病诊断等许多领域显示出了巨大的应用潜力。随着研究深入,研究人员发现纳米酶普遍具有多酶活性。虽然多酶活性的级联反应为疾病诊疗提供了新思路,但是也存在纳米酶在体内的催化活性难以预测与调控的问题。同时,多数纳米酶难以在生物体内分解代谢,因此体内转化应用比较受限。
近日,中国科学院生物物理研究所/中国科学院纳米酶工程实验室阎锡蕴院士、高利增和范克龙团队,通过分析自然界中最主要的几类氧化铁,发现水铁矿(Fe5HO8·4H2O)是一种相对专一的类过氧化氢纳米酶,并且可以被细胞有效分解代谢,具有良好的生物相容性。这一发现为突破纳米酶体内应用的瓶颈提供了一种新的思路。
研究发现,相比于其他形式的氧化铁材料,水铁矿具有最高的类过氧化氢酶活性,且其催化效率在pH 4.0~8.7的范围内保持恒定。值得关注的是,传统Fe3O4纳米酶在酸性条件下具有显著的类过氧化物酶活性,而水铁矿的类过氧化物酶活性却微乎其微。另外,水铁矿也几乎不具有超氧化物歧化酶与氧化酶等其他类酶活性。这种相对专一的催化活性使得水铁矿纳米酶作为一种研究类过氧化氢酶活性的模式材料成为可能。
为了深入研究高活性水铁矿纳米酶的催化机制,研究人员对比分析了多种氧化铁材料的各项理化参数与类酶活性之间的关联性。结果表明,氧化铁表面铁合羟基的丰度与类过氧化氢酶活性之间存在指数相关关系。相比于其他氧化铁,水铁矿的表面含有丰富的铁合羟基。第一性原理计算分析表明,这些铁合羟基基团在促进H2O2分解产生O2的过程中起着关键作用。在一个完整的水铁矿过氧化氢纳米酶催化循环过程中,首先铁合羟基基团通过产生H空位的方式促使一个H2O2分子碱式分解;当第二个H2O2分子靠近催化中心时,H空位可以较容易夺取过氧化氢中的氢元素,从而促使它酸式分解产生O2。通过在合成过程中调控水铁矿的表面羟基丰度,可以规律性地调节水铁矿的类过氧化氢酶活性。实验数据和理论计算结果表明,表面铁和铁合羟基形成的催化中心可能是水铁矿过氧化氢纳米酶的类酶催化位点。
肿瘤组织乏氧是当下放疗耐受的重要原因之一。肿瘤细胞的无序增殖和代谢异常会产生大量的H2O2,可以被过氧化氢酶(或纳米酶)原位分解为O2以克服乏氧。相比于以往的纳米酶,水铁矿的类过氧化氢酶活性相对专一,并且在生理环境中催化效率维持恒定。另外,水铁矿本身作为铁蛋白的内核在生物体内广泛存在,具有较好的生物相容性和安全性。考虑到水铁矿纳米酶的独特理化性质,研究人员利用叶酸配体对其进行改性以提高肿瘤靶向性,尝试将其开发为一种有效且安全的放疗增敏剂。体外和体内实验结果表明,经改性后的水铁矿纳米酶能够催化分解肿瘤内的高水平H2O2生成O2,缓解肿瘤部位的乏氧状态,并有效增强放射治疗的效果。另外,水铁矿纳米酶能够被巨噬细胞高效分解代谢,具有良好的生物可降解性。这些实验结果为水铁矿纳米酶的体内应用奠定了良好的研究基础。
本研究首次报道了具有相对专一活性的水铁矿-过氧化氢纳米酶,阐明了其催化活性位点与催化机制,并首次证实了将水铁矿纳米酶用于肿瘤放疗增敏的有效性和安全性,为纳米酶的构-效关系与体内应用研究提供了新的模式材料和方法。这项研究近期发表于国际学术期刊《Nano Today》杂志(IF = 20.722),中国科学院生物物理研究所/中国科学院纳米酶工程实验室阎锡蕴院士、高利增研究员和范克龙研究员为本文通讯作者。中国科学院生物物理研究所博士后张若飞、助理研究员陈雷和博士后梁倩为本文共同第一作者。国家纳米中心高兴发研究员对水铁矿纳米酶的催化机制进行了指导。北京大学医学部刘昭飞教授和西北大学的刘晓丽教授在肿瘤放射治疗与光声成像方面提供了技术指导与帮助。该研究得到国家重点研发计划、国家自然科学基金、中科院创新交叉团队等项目的资助。
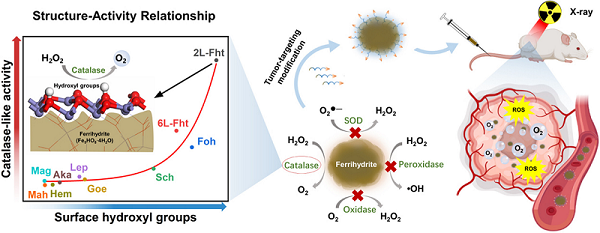
图1.氧化铁纳米酶的表面铁合羟基的丰度与其类过氧化氢酶活性之间存在指数相关关系。水铁矿因具有高丰度的表面铁合羟基而表现出最显著的类过氧化氢酶活性,并且几乎不具有类过氧化物酶、超氧化物歧化酶和氧化酶等活性。经靶向配体改性后,水铁矿过氧化氢纳米酶能够有效缓解肿瘤部位的乏氧状态,助力放射治疗。
文章链接:https://www.sciencedirect.com/science/article/pii/S1748013221002425
(供稿:范克龙研究组)